Ponts salins de llarga durada proporcionen el mecanisme d’ancoratge de les proteïnes oncogèniques KRas-4B a les membranes cel·lulars
30/12/2020
Huixia Lu i Jordi Marti del group de recerca SIMCOM del departament de Física publiquen un article sobre el mecanisme d’ancoratge a la membrana cel·lular de certes proteines relevants per estudis oncològics
L’oncologia és una branca de la medicina que estudia els tumors benignes i malignes; els darrers coneguts com a càncers. L'oncologia comença amb la prevenció, destinada a reduir la incidència del càncer, seguint amb l'assistència als malalts i, finalment, es completa amb la recerca, que s'ocupa de l'estudi de tots els elements que intervenen en el desenvolupament de les malalties malignes i els seus tractaments.
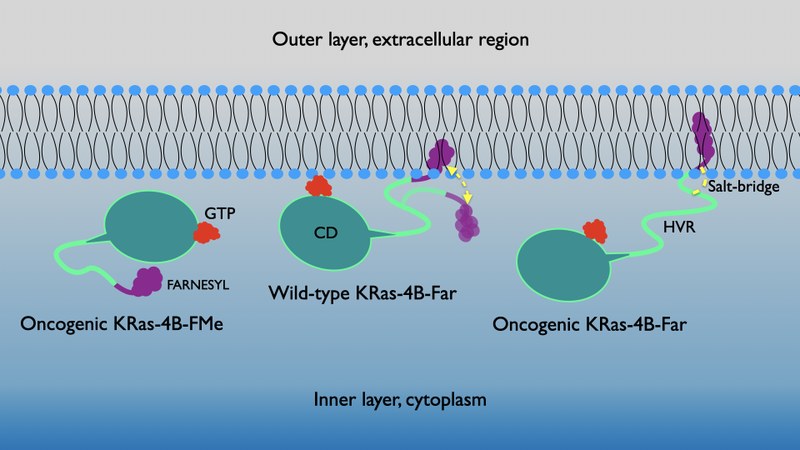
Les proteïnes Ras, juntament amb el gen que porta el mateix nom, són un conjunt d'interruptors-reguladors moleculars molt importants en una gran varietat de rutes de transmissió de senyals cel·lulars que controlen diferents fenòmens com ara la integritat del citoesquelet, la proliferació, diferenciació, adhesió i migració cel·lular i l'apoptosi. Tant el gen com les proteïnes Ras relacionades, sovint estan alterats en una gran varietat de tumors malignes, provocant un augment en la capacitat d'invasió i metàstasi, i una disminució de l’apoptosi. En particular, les proteïnes Ras estan directament involucrades en els càncers de pulmó, còlon i pàncrees. Dites proteïnes funcionen com a commutadors binaris entre guanosina-difosfatasa i guanosina-trifosfatasa (GDP-GTP) i són capaces de regular les xarxes de senyalització citoplasmàtica que controlen diversos processos cel·lulars, jugant un paper essencial en la senyalització de vies de transducció implicades en el creixement, la diferenciació i la supervivència cel·lular, de tal manera que es creu que la senyalització excessiva és el que pot provocar el creixement dels tumors. Un dels reptes més difícils d’afrontar és el disseny de mutacions selectives que duguin a estratègies terapèutiques eficients. En aquest treball, la proteïna lligada a GTP "Kirsten rat sarcoma" (KRas-4B) amb cua farnesilada i mutada a l’aminoàcid G12 ha estat simulada a la interfície d’un model de membrana cel·lular aniònica (DOPC/DOPS/colesterol). Mitjançant simulacions de dinàmica molecular i metadinàmica, un pont salí específic de llarga durada entre el grup farnesil i la regió hipervariable de la proteïna s'ha identificat com el principal mecanisme responsable de la unió de la KRas-4B a la membrana cel·lular. Les hipersuperfícies d’energia lliure han permès caracteritzar els seus mínims globals i locals, els quals ens revelen les vies principals de transició entre estats ancorats i no-ancorats.
El resultats han estat publicats recentment a l’article amb títol: «Ponts salins de llarga durada proporcionen el mecanisme d’ancoratge de les proteïnes oncogèniques KRas-4B a les membranes cel·lulars» a la revista The Journal of Physical Chemistry Letters. La referència a l’article és:
H.Lu and J.Martí, J. Phys. Chem. Lett. 2020, 11, 9938−9945.
Comparteix: